이경태 , 허소윤 , 홍영기
전기방사를 이용한 이중층 구조 나노 섬유 골 유도 재생 차폐막의 제조와 특성
Fabrication and Properties of Electrospun Double-Layered Nanofibrous Membranes for Guided Bone Regeneration
Gyeong Tae Lee, So Yun Heo, and Young Ki Hong
Abstract: Guided bone regeneration (GBR) is a surgical technique that promotes bone formation by using a barrier membrane during implant placement or in cases of alveolar bone defects. The membrane prevents the infiltration of rapidly proliferating fibrous connective and epithelial tissues while providing a physical space for osteogenic cell growth. However, conventional membranes often exhibit hydrophobic properties, which limit cell adhesion and proliferation. To address this limitation, a hydrophilic nanofibrous barrier layer was fabricated by electrospinning a blend of biodegradable poly(ε-caprolactone) (PCL) and hydrophilic polyvinylpyrrolidone (PVP). Subsequently, to ensure sufficient mechanical integrity, a double-layered nanofibrous membrane was prepared by electrospinning a PCL/poly(glycolic acid) (PGA) solution. The membranes were characterized by attenuated total reflectance-Fourier transform infrared spectroscopy (ATR-FTIR) and scanning electron microscopy (SEM). Surface hydrophilicity was evaluated via water contact angle (WCA) measurements, mechanical properties were analyzed using a universal testing machine (UTM), and cytocompatibility was assessed through a lactate dehydrogenase (LDH) assay based on extract testing. The PCL/PVP layer exhibited a tensile strength below 1 MPa, which increased to 8.62 MPa after forming the double-layered structure. All samples demonstrated over 70% cell viability in the LDH-based cytotoxicity test, confirming the potential of the developed membranes as biodegradable barrier materials for guided bone regeneration.
Keywords: guided bone regeneration , barrier membrane , polycaprolactone , electrospinning , nanofibrous
1. 서 론
치주는 치조골, 치주인대, 치은 및 백악질로 구성된 조직으로 치아의 고정과 보호의 역할을 한다[1]. 노화 또는 세균 감염에 의해 발생하는 치주질환은 치조골과 치주인대의 괴사와 결손을 일으키고 치아의 탈락을 유발한다. 치주질환의 치료는 스케일링, 치근활택술과 같은 비외과적인 방법과 항생제, 소독액 등을 이용한 약물치료, 골 유도 재생술(guided bone regeneration, GBR)과 같은 외과적 방법으로 구분되며, 결손 부위의 범위와 상태에 따라 치료방법을 선택한다[2,3].
치주질환으로 인해 치은과 치조골에 결손이 발생하고 치유 과정에서 재생속도의 차이로 정상적인 회복이 방해받을 수 있다. 치은은 치조골보다 빠르게 재생되므로, 치조골이 재생될 수 있는 공간을 확보해주어야 한다. 골 유도 재생술은 차폐막(barrier membrane)을 물리적 장벽으로 활용하여, 치조골이 재생될 충분한 공간과 시간을 제공함으로써 정상적인 치유를 유도하는 방법이다[4,5]. 골 유도 재생술에 사용되는 차폐막은 비흡수성과 흡수성으로 구분되며, 비흡수성 차폐막의 경우 기계적 강도가 높아 재생 공간 확보에 유리하지만 제거를 위한 2차 수술이 필요하다는 단점이 있다[6,7]. 흡수성 차폐막은 생분해성 천연고분자 또는 합성고분자로 제조되며, 조직이 재생되는 동안 물리적 장벽으로의 역할 후 분해·흡수되어 추가적인 외과적 수술이 요구되지 않는다. 그러나 치조골이 재생되기 전 분해될 수 있고, 비흡수성 차폐막에 비해 기계적 강도가 낮아 충분한 재생 공간이 확보되지 않을 수 있다[8]. GBR 차폐막은 물리적 공간을 확보할 뿐만 아니라, 골 형성 세포가 부착·증식할 수 있는 표면 환경을 제공하는 것이 중요하다. 차폐막 표면의 친수성은 세포 부착 및 확산을 촉진하여 초기 골 재생을 유도할 수 있다.
Polycarprolactone (PCL)은 생분해성이 우수한 합성고분자로 뛰어난 생체적합성, 가공성 및 유연성을 가지고 있으며 고분자 간 혼합성이 우수한 소재이다. 그러나 소수성 특성으로 인해 세포 접착력이 낮다는 한계를 가지고 있다[9]. PCL의 소수성 특성을 개선하기 위해 표면처리, 플라즈마 처리, 표면 코팅 및 고분자 블렌딩 등 다양한 연구가 진행되고 있다. Polyvinylpyrrolidone (PVP)는 친수성 고분자로 우수한 열적 안정성, 필름 형성 등의 특성으로 제약, 생체 재료 등 다양한 분야에서 사용되고 있다. Polyglycolic acid(PGA)는 체내에서 흡수, 분해되는 생분해성 합성고분자 물질로 우수한 생체적합성, 기계적 강도를 가지고 있다. 따라서 수술용 봉합사, 흡수성 의료용 mesh, 조직 지지체(scaffold) 등 다양한 의료용 재료로 사용되고 있다[10,11].
전기방사(electrospinning)는 점도를 지닌 고분자 용액에 정전기력을 가하여 섬유를 형성하는 공정이다. 고분자 용액을 일정 속도로 토출하면서 고전압을 인가하면 표면장력과 정전기력이 균형을 이뤄 Taylor cone을 형성하고, 이후 Jet가 방출 된다. 방출된 Jet는 연신 과정을 통해 용매의 증발과 함께 나노 크기의 섬유로 형성된다. 전기방사 공정을 이용한 섬유 형성에서 방사하고자 하는 용액의 특성과 토출부와 수집체 사이의 거리, 전기장의 세기, 방사 시간 등의 공정 변수에 따라 섬유의 특성을 조절할 수 있다[12,13]. 제조된 나노 섬유 시트는 다공성 구조, 상호 연결된 기공 구조 및 높은 표면적을 가지고 있어 조직 공학, 바이오 센서, 상처 피복재 및 약물 전달 등 다양한 응용 분야에서 사용되고 있다[14,15].
본 연구에서는 세포 부착성을 향상시키기 위해 생분해성 고분자인 PCL과 친수성 고분자인 PVP를 혼합한 용액, 그리고 기계적 강도를 보완하기 위해 PCL과 PGA를 혼합한 용액을 전기방사 공정을 통해 각각 적층하여 이중층 구조의 골 유도 재생 차폐막을 제조하고자 하였다. PCL/PVP 및 PCL/PGA의 혼합 비율을 변수로 하여 화학적, 형태학적, 기계적 특성 및 생체적합성 평가를 통해 이중층 구조의 골유도 재생 차폐막의 제조 조건의 최적화를 목적으로 두고 있다.
2. 실험 및 방법
2.1. 재 료
생분해성 나노섬유 차폐막 제조에 사용된 생분해성 고분자인 polycaprolactone (PCL)과 polyglycolic acid (PGA)는 Sigma-Aldrich에서 구매하였다. 친수성 고분자로 사용된 polyvinylpyrrolidone (PVP, K30)는 Sigma-Aldrich에서 구매하였으며, 용매로 사용한 chloroform (CF)과 hexafluoroisopropanol (HFIP)은 각각 Waco와 TCI에서 구매하여 사용하였다.
2.2. 방사 용액 제조
전기방사를 이용한 이중층 구조 나노섬유 차폐막을 제조하기 위한 고분자 용액의 조성은 Table 1에 나타내었다. Hy_x 방사 용액은 생분해성 고분자인 PCL과 친수성 고분자인 PVP를 일정 비율로 혼합한 후, CF 용매에서 100 rpm으로 24시간 동안 교반하여 제조하였다. PVP의 함량에 따라 Hy_x로 명명하였다. H_x 방사 용액은 생분해성 고분자인 PCL을 일정 농도로 CF에 용해시키고, PGA를 HFIP에 Table 1의 조성에 따라 각각 100 rpm으로 24시간 동안 교반하여 개별 용액을 제조하였다. 제조된 PCL 용액과 PGA 용액을 1:1 비율로 혼합하여 방사 용액을 제조하였으며, 조성에 따라 H_x로 명명하였다.
Table 1.
| PCL (wt%) | PVP (wt%) | CF (wt%) | ||
|---|---|---|---|---|
| Hy_1 | 7 | 1 | 92 | |
| Hy_3 | 7 | 3 | 90 | |
| Hy_5 | 7 | 5 | 88 | |
| Hy_7 | 7 | 7 | 86 | |
| Hy_9 | 7 | 9 | 84 | |
| Hy_11 | 7 | 11 | 82 | |
| PCL (wt%) | CF (wt%) | PGA (wt%) | HFIP (wt%) | |
| H_5 | 7 | 93 | 5 | 95 |
| H_7 | 7 | 93 | 7 | 93 |
| H_10.5 | 7 | 93 | 10.5 | 89.5 |
2.3. 전기 방사법을 이용한 나노섬유 차폐막 제조
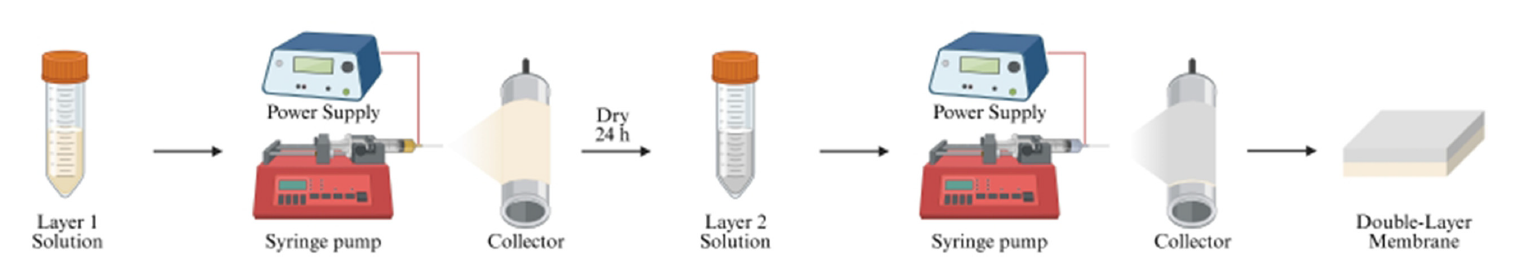
제조된 방사 용액을 전기방사 하여 나노섬유 차폐막을 제조하였으며, 전기방사 공정은 Figure 1에 나타내었다. Hy_x 방사 용액을 23 G 니들을 통해 방사하였으며, 양전압 15 kV, 유량 5 ml/h의 조건에서 진행하였다. 드럼형 수집체는 150 rpm으로 설정하였고, 수집체와 토출부 사이 거리는 15 cm로 유지하였다. 수집된 Hy_x 상단에 H_x 방사용액을 동일한 크기의 니들과 방사 조건으로 방사하여 double-layer membrane을 제조하였다.
Figure 1.
2.4. 화학적 특성 평가
이중층 구조 나노섬유 차폐막의 화학적 구조를 분석하기 위해 Attenuated Total Reflectance Fourier Transform Infrared(ATR FT-IR, FT/IR-4X, Jasco)를 이용하여 4000−650 cm-1의 파수 범위에서 4 cm-1의 분해능으로 스펙트럼을 측정하였다.
2.5. 형태학적 특성 평가
제조된 나노섬유 차폐막의 형태학적 특성 분석을 위해 전계방사형 주사전자현미경(FE-SEM, Apreo 2, Thermo Fisher Scientific)을 사용하였다. 시료는 백금 코팅으로 전처리한 후, 5 kV 가속 전압에서 관찰하였다. 나노섬유 차폐막의 섬유 평균 직경은 Image J 소프트웨어를 이용하여 측정하였다.
2.6. 친수성 평가
제조된 나노섬유 차폐막의 표면 친수성은 접촉각 측정기(Phoenix 10, Surface Electro Optics)를 통하여 물 접촉각을 통해 측정하였다. 차폐막 표면에 물방울을 적가한 후 접촉각을 모니터와 SurfaceWare 9 프로그램을 사용하여 분석하였다.
2.7. 기계적 특성 평가
PCL/PGA의 비율에 따른 H_x와 친수성 고분자 PVP 함량에 따른 Hy_x의 기계적 특성은 Universal Testing Machine(UTM, AGS-X STD, Shimadzu)을 사용하여 평가하였다. 시료는 길이 40 mm, 너비 10 mm로 절단하여 양 끝을 고정한 후, 크로스헤드 속도 5 mm/min의 조건에서 인장 시험을 수행하였다.
2.8. In vitro 세포 독성 평가
나노섬유 차폐막의 세포독성 평가는 KS ISO 10993-5 기준에 따라 LDH assay로 평가하였다. NIH 3T3 섬유아세포는 1% penicillin-streptomycin과 10% 우태아혈청(FBS)이 첨가된 Dulbecco’s Modified Eagle Medium (DMEM)에서 5% [TeX:] $$\mathrm{CO}_2, 37^{\circ} \mathrm{C}$$ 조건에서 배양하였다. 시료의 용출은 6 cm2/ml 조건으로 24시간 동안 DMEM에서 침적하였으며, 96-well plate에 용출물을 각 100 μl씩 처리하여 세포를 배양하였다. 배양 후 상층액을 획득하여 LDH assay kit를 사용하여 반응시켰으며, 450 nm에서 ELISA를 이용하여 흡광도를 측정하였다. 아래의 식 (1)를 이용하여 세포 생존율(cell viability)을 산출하였다.
A : Exp. - Background control
B : Low control - Background control
C : High control - Volume control
3. 결과 및 고찰
3.1. 이중층 나노섬유 차폐막의 화학적 특성 분석
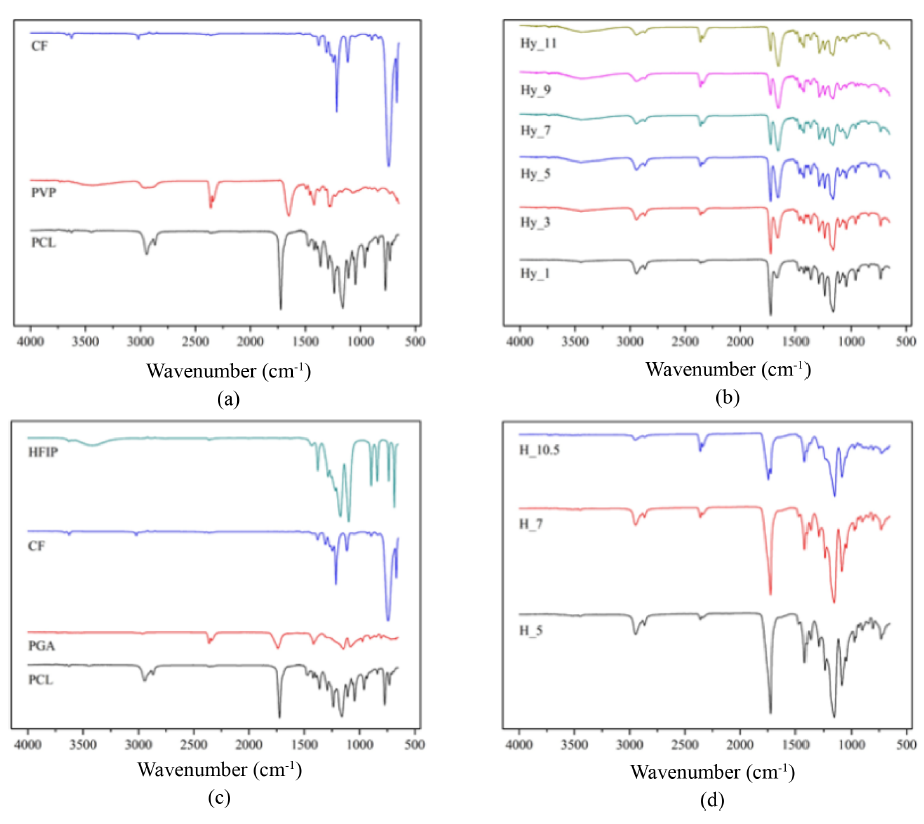
전기방사를 통해 제조된 이중층 나노섬유 차폐막의 화학적 구조를 특성화하기 위해 ATR-FTIR 분석을 Figure 2에 나타내었다. Figure 2(a)는 Hy_x 층을 구성하는 PCL, PVP, CF의 스펙트럼을 나타내었으며, Hy_x의 주요 구성 성분인 PCL에서는 C=O stretching에 해당하는 1724 cm-1와 C-O-C stretching에 해당하는 1293 cm-1, 1238 cm-1 및 1160 cm-1에서 peak를 관찰하였다. Hy_x에 친수성을 부여하기 위해 첨가된 PVP는 C=O lactam stretching에 기인하는 1648 cm-1에서 특징적인 peak를 나타냈으며, 용매로 사용된 CF는 742 cm-1에서 C-Cl stretching에 의한 peak를 확인하였다. Figure 2(b)는 PVP 함량에 따른 Hy_x의 스펙트럼을 나타내었다. 친수성 고분자인 PVP의 함량이 증가할수록 PVP에서 관찰된 1648 cm-1의 peak의 강도가 증가하는 것을 확인하였다. 또한 용매인 CF에서 관찰되었던 742 cm-1에서 peak가 관찰되지 않았으며, 이를 통해 유기용매가 완전히 휘발되었음을 확인하였다.
H_x 층을 구성하는 PCL, PGA, CF, HFIP의 스펙트럼을 Figure 2(c)에 나타내었으며, PCL에서는 1724 cm-1(C=O stretching)와 1293 cm-1, 1238 cm-1 및 1160 cm-1(C-O-C stretching)에서 peak를 관찰하였다. 기계적 강도를 보완하기 위해 첨가한 PGA는 C=O ester stretching에 기인하는 1739 cm-1에서 특징적인 peak를 확인하였으며, 용매로 사용된 CF와 HFIP는 각각 C-Cl stretching에 의한 742 cm-1와 O-H stretching에 의한 3412 cm-1에서 peak를 확인하였다. Figure 2(d)에서는 PCL과 PGA의 비율에 따라 제조된 H_x의 spectra를 나타내었다. PCL과 PGA의 비율에 따라 화학적 조성의 큰 차이는 나타나지 않았으며, PGA의 비율이 높아짐에 따라 PCL에 의한 1724 cm-1의 peak에서 PGA의 C=O ester stetching에 기인하는 1745 cm-1 peak가 분리되는 것을 확인하였다. 또한 용매로 사용한 CF와 HFIP의 주요 peak들이 소실된 것으로 용매의 완전한 휘발을 확인하였다.
Figure 2.
3.2. 이중층 나노섬유 차폐막의 형태학적 특성 분석
이중층 나노섬유 차폐막에서 친수성 고분자인 PVP 함량에 따른 Hy_x의 형태학적 특성을 분석하기 위한 SEM image를 Figure 3에 나타내었으며, Hy_x의 두께와 섬유의 직경을 Table 2에 나타내었다. Figure 3(a)−(f)는 PVP의 함량에 따른 Hy_1~Hy_11의 SEM image로 모든 Hy_x의 섬유 샘플에서 구슬 모양의 뭉침 현상인 비드(bead)가 형성되지 않고 균일한 섬유가 형성되었음을 확인하였다. 제조된 Hy_x의 섬유 두께는 [TeX:] $$74 \pm 9 \mu \mathrm{m}, 82 \pm 7 \mu \mathrm{m}, 92 \pm 11 \mu \mathrm{m}, 82 \pm 13 \mu \mathrm{m}, 86\pm 18.2 \mu \mathrm{m}, \text{ 및 } 98 \pm 19.2 \mu \mathrm{m},$$로 비교적 일정한 두께를 가지고 있었다. 또한 섬유 직경은 [TeX:] $$3.595 \pm 0.609 \mu \mathrm{m}, 3.741 \pm 0.379 \mu \mathrm{m}, 3.947 \pm 0.533 \mu \mathrm{m}, 3.684 \pm 0.680 \mu \mathrm{m}, 3.818\pm 0.705 \mu \mathrm{m}, \text{ 및 } 3.541 \pm 0.776 \mu \mathrm{m},$$로 측정되었으며, PVP 함량 변화에 따른 유의미한 차이는 관찰되지 않았다. 따라서 PVP 함량 변화가 섬유의 두께와 직경에 큰 영향을 미치지 않음을 확인하였다.
Figure 3.

Table 2.
| Sample name | Hy_1 | Hy_3 | Hy_5 | Hy_7 | Hy_9 | Hy_11 |
|---|---|---|---|---|---|---|
| Thickness (μm) | 74±9 | 82±7 | 92±11 | 82±13 | 86±18.2 | 98±19.2 |
| Diameter (μm) | 3.595±0.609 | 3.741±0.379 | 3.947±0.533 | 3.684±0.680 | 3.818±0.705 | 3.541±0.776 |
이중층 나노섬유 차폐막에서 PCL/PGA의 비율에 따른 H_x의 형태학적 특성을 분석하기 위한 SEM image와 이중층으로 구조화한 샘플인 DLM(double-layer membrane)의 단면 SEM image를 Figure 4에 나타내었으며, H_x의 두께와 섬유의 직경을 Table 3에 나타내었다. Figure 4(a)−(c)는 PCL/PGA의 비율에 따른 H_x의 SEM image로 모든 H_x 샘플에서 비드의 형성 없이 매끄러운 섬유의 형태를 확인하였다. 제조된 H_x의 섬유 두께는 H_5가 [TeX:] $$70 \pm 12 \mu \mathrm{m}$$, H_7이 [TeX:] $$82 \pm 11 \mu \mathrm{m}$$, H_10.5가 [TeX:] $$20 \pm 10 \mu \mathrm{m}$$로 확인되었으며, 섬유의 직경은 [TeX:] $$0.916 \pm 0.537 \mu \mathrm{m}, 0.3201 \pm 0.707 \mu \mathrm{m}, 1.628 \pm 0.431 \mu \mathrm{m}$$로 측정되었다. PGA의 비율이 높은 H_10.5에서 섬유의 두께가 감소한 것은 PCL은 점도와 점착성이 우수하여 안정적인 섬유 형성이 되지만, PGA는 분자간 상호작용이 크게 작용하기 때문에 분자 사슬 유연성이 낮아 연속적인 제트의 형성을 방해할 수 있으며, 용매로 사용된 HFIP의 경우 휘발성이 높아 제트가 형성되는 동안 빠르게 휘발되어 제트의 형성을 방해한 것으로 사료된다[16]. 섬유의 직경의 경우 H_7에서 PGA의 비율이 증가함에 따라 방사 용액의 점도가 증가하여 섬유의 직경이 증가하는 경향을 보였으나, H_10.5에서의 섬유 직경 감소는 PGA가 상대적으로 극성 구조를 가지고 있어 용액의 전기 전도도가 향상되어 섬유의 직경이 감소한 것으로 판단된다[17].
Figure 4.

Table 3.
| Sample name | H_5 | H_7 | H_10.5 |
|---|---|---|---|
| Thickness (μm) | 70±12 | 82±11 | 20±10 |
| Diameter (μm) | 0.916±0.537 | 3.201±0.707 | 1.628±0.431 |
3.3. 이중층 나노섬유 차폐막의 표면 친수성 분석
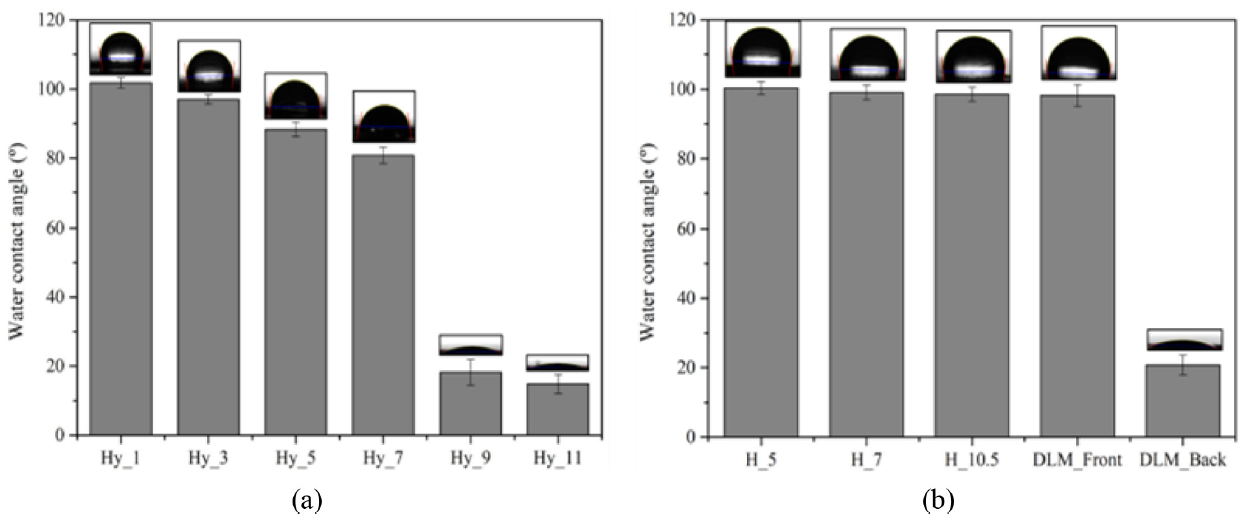
제조된 이중층 나노섬유 차폐막의 표면 친수성 측정 결과를 Figure 5에 제시하였다. Figure 5(a)는 PVP 함량에 따른 Hy_x의 접촉각 측정 결과로 Hy_1은 [TeX:] $$101.82^{\circ}$$, Hy_3은 [TeX:] $$96.96^{\circ}$$, Hy_5는 [TeX:] $$88.28^{\circ}$$, Hy_7은 [TeX:] $$80.78^{\circ}$$로 측정되었으며, PVP의 첨가에 따라 약 [TeX:] $$20^{\circ}$$의 접촉각 감소를 확인하였다. Hy_9와 Hy_11은 각각 [TeX:] $$18.18^{\circ} \text{ 와 } 14.84^{\circ}$$의 접촉각 결과로 친수성 고분자인 PVP가 9 wt% 이상 첨가되었을 때, 표면 친수성이 크게 향상되는 것을 확인하였다. Figure 5(b)는 PCL/PGA 비율에 따라 제조된 H_x의 접촉각 측정 결과 및 Hy_9와 H_7를 조합하여 제조한 DLM의 전·후면 접촉각 결과를 나타내었다. H_5에서 [TeX:] $$100.32^{\circ}$$, H_7에서 [TeX:] $$99.06^{\circ}$$, H_10.5에서는 [TeX:] $$98.52^{\circ}$$로 높은 접촉각 결과를 보이며 소수성을 확인하였다. DLM_Front (H_7)에서는 [TeX:] $$98.18^{\circ}$$로 소수성을 보였으며, DLM_Back (Hy_9)에서는 [TeX:] $$20.78^{\circ}$$로 표면 친수성이 유지되는 것을 확인하였다.
Figure 5.
3.4. 이중층 나노섬유 차폐막의 기계적 특성 분석
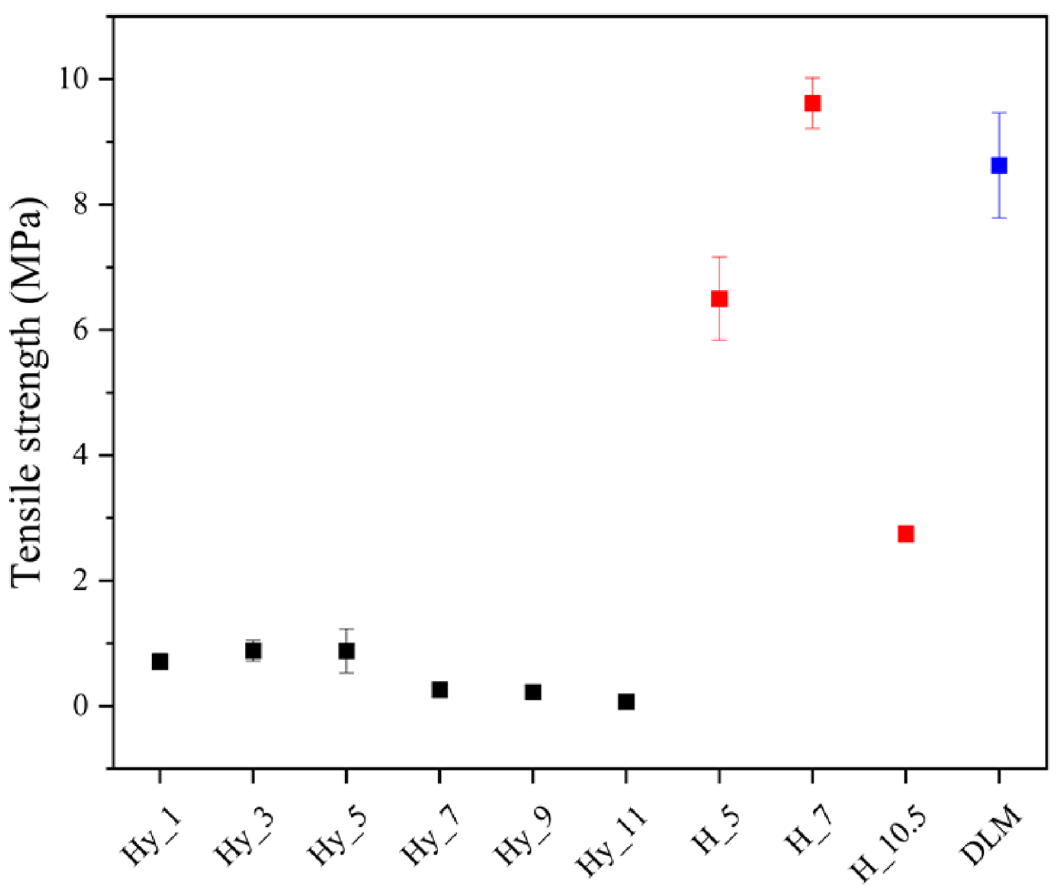
차폐막은 치조골이 재생될 충분한 공간과 시간을 제공하는 물리적 장벽으로, 기계적 특성이 요구된다. 제조된 이중층 나노섬유 차폐막의 인장강도 측정 결과를 Figure 6에 제시하였다. PVP 함량에 따른 Hy_x의 인장강도 결과는 모든 샘플에서 1 MPa 이하로 나타났으며, 특히 Hy_7, Hy_9 및 Hy_11에서 인장강도의 감소를 확인하였다. 이는 PCL과 PVP 폴리머 사슬 간의 물리적 상호작용이 약하여 응집력이 감소했기 때문으로 판단된다[18,19]. PCL과 PGA의 비율에 따른 H_x의 인장강도는 H_5에서 6.50±0.664 MPa, H_7에서 9.62±0.405 MPa의 결과로 PGA의 비율이 증가할수록 인장강도가 향상되는 경향을 보였다. PGA의 비율이 가장 높은 H_10.5의 경우 2.75±0.129 MPa로 인장강도가 급격히 감소하였다. 이는 H_5 및 H_7에 비해 H_10.5의 경우 제조된 섬유의 두께가 [TeX:] $$20 \pm 10 \mu \mathrm{m}$$로 얇아 인장강도가 감소한 것으로 판단된다. 친수성 측정 및 기계적 특성 결과를 기반으로 Hy_9와 H_7를 조합한 DLM의 인장강도는 8.62±0.840 MPa로 나타났다. 국내 시판되고 있는 A사의 차폐막 제품의 인장강도 결과 해당 제품은 197 μm의 두께를 가지고 있었으며, 5.5 MPa의 인장강도를 보였다. PCL, PVP 및 PGA를 이용한 이중층 구조 나노섬유 차폐막은 충분한 기계적 특성을 가지고 있어 의료용 차폐막으로 상용화 가능성을 보여준다.
3.5. 이중층 나노섬유 차폐막의 세포 독성 분석
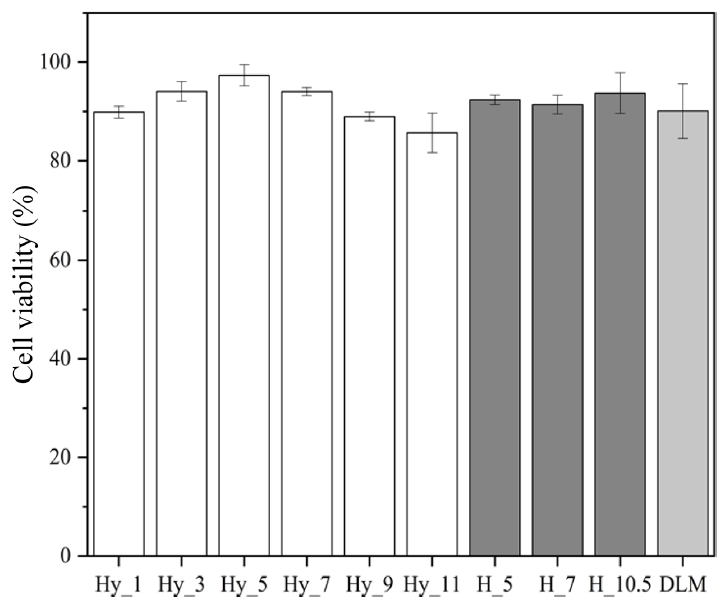
차폐막은 체내에 삽입되어 일정 기간 체내에 잔류하며 생체 조직과 접촉하는 의료기기로 생체적합성이 필수적으로 요구된다. PCL, PVP 및 PGA를 이용한 Hy_x, H_x 및 이중층 구조 나노섬유 차폐막인 DLM의 세포 독성을 LDH assay로 평가하였으며, Figure 7에 나타내었다. Lysis buffer로 세포의 사멸을 유도한 high control에서는 0%의 세포 생존율을 확인하였다. PCL과 PVP를 혼합한 Hy_x는 PVP의 함량의 증가에 따라 각각 89.87%, 94.07%, 97.35%, 94.04%, 88.99% 및 85.68%의 세포 생존율을 확인하였다. PCL과 PGA를 혼합한 H_x는 H_5에서 92.37%, H_7에서 91.41% 그리고 H_10.5에서 93.75%의 세포 생존율을 확인하였으며, Hy_9과 H_7를 조합한 DLM에서는 90.09%로 관찰되었다. 제조된 Hy_x, H_x 및 DLM 모델 모두 세포 생존율이 70% 이상임이 확인되어 NIH 3T3 세포에 대한 세포적합성이 우수하다고 판단된다[20].
4. 결 론
본 연구에서는 전기방사를 이용한 이중층 구조 나노섬유 차폐막의 제조 및 특성 평가 결과 다음과 같은 결론을 얻을 수 있었다.
1. FT-IR 스펙트럼 분석 결과, PCL/PVP/PGA의 특징적인 peak가 확인되었으며, PVP와 PGA의 함량 증가에 따라 peak의 강도 증가를 확인하였다. 또한 사용된 유기용매의 주요 peak가 관찰되지 않아 완전히 휘발된 것을 확인하였다.
2.형태학적 분석 결과, Hy_x에서 PVP의 함량 변화가 섬유의 두께와 직경에 큰 영향을 미치지 않는 것으로 확인되었으며, H_x에서는 PGA의 비율에 따라 섬유의 두께와 직경의 변화를 확인하였다.
3.접촉각 측정 결과, PVP의 증가에 따라 표면 친수성이 향상되었으며, 특히 Hy_9 이상에서 친수성이 크게 증가하였다. 이중층 구조의 DLM은 한쪽 면은 [TeX:] $$98.18^{\circ}$$의 소수성 특성과 반대쪽 면은 [TeX:] $$20.78^{\circ}$$로 친수성을 확인하였다.
4.기계적 특성 분석 결과, Hy_x는 PVP의 함량 증가에 따라 인장강도가 감소하는 것을 확인하였다. H_7은 9.62 MPa로 가장 높은 인장 강도를 보였으며, PGA의 비율이 증가한 H_10.5에서는 섬유 두께 감소로 인해 인장강도의 감소를 확인하였다. DLM은 8.62 MPa의 인장강도로 이중층 구조화를 통해 충분한 인장강도를 확인하였다.
5. LDH assay를 이용한 In vitro 세포 독성 분석 결과, 모든 샘플에서 70 %의 세포 생존률을 보여 낮은 세포 독성을 확인하였으며, 본 연구를 통해 개발된 이중층 구조 나노 섬유 차폐막의 의료용 생체재료로서 가능성을 확인할 수 있었다.
References
- 1 D. W . Green, J. S. Lee, and H. S. Jung, "Small-scale Fabrication of Biomimetic Structures for Periodontal Regeneration, " Front. Physiol., 2016, 7, 6.custom:[[[-]]]
- 2 D. Y. Park, B. O. Kim, and S. J. Yu, "Possibility of Periodontal Tissue Regeneration with Tooth Replantation: A Literature Review" , Oral Biol. Res., 2015, 39, 87-94.custom:[[[-]]]
- 3 I. Elgali, O. Omar, C. Dahlin, and P . Thomsen, "Guided Bone Regeneration: Materials and Biological Mechanisms Revisited" , Eur. J. Oral Sci., 2017, 125, 315-337.custom:[[[-]]]
- 4 D. Wang, X. Zhou, H. Cao, H. Zhang, D. Wang, J. Guo, and J. Wang, "Barrier Membranes for Periodontal Guided Bone Regeneration: A Potential Therapeutic Strategy" , Front. Mater., 2023, 10, 1220420.custom:[[[-]]]
- 5 D. Lee, S. J. Lee, J. H. Moon, J. H. Kim, D. N. Heo, J. B. Bang, H. N. Lim, and I. K. Kwon, "Preparation of Antibacterial Chitosan Membranes Containing Silver Nanoparticles for Dental Barrier Membrane Applications", J. Ind. Eng. Chem., 2018, 66, 196-202.custom:[[[-]]]
- 6 G. G. Sam and B. R. M. Pillai, "Evolution of Barrier Membranes in Periodontal Regeneration—"Are the Third Generation Figure 7. Cell viability of Hy_x, H_x, and DLM samples evaluated by LDH release in NIH3T3 cells.custom:[[[-]]]